ИЗОМЕРИЯ И ЕЕ ВИДЫ
Цели урока. Раскрыть основное положение теории строения на явление изомерии. Дать общее представление о типах изомерии. Показать основные направления развития теории строения на примере стереоизомерии.
Оборудование: модели молекул Стюарта — Бриглеба или шаростержневые, цветной пластилин, спички, пара перчаток, семена тмина, мятная жевательная резинка, три пробирки.
I. Теория строения и явление изомерии
В начале урока учитель просит учащихся дать определение изомерии и изомерам и объяснить причину их существования, а затем переходит к объяснению. Явление изомерии (от греческих слов isos – равный и meros - доля, часть) было открыто в 1823 г. Ю. Либихом и Ф. Вёлером на примере солей двух неорганических кислот: циановой и гремучей.
В 1830 г. Ж. Дюма распространил представление об изомерии на органические соединения. Термин изомер появился годом позже, и предложил его «патриарх органической химии» И. Берцелиус. Поскольку в области строения как органических, так и неорганических веществ в то время царил полный хаос, открытию не придали особого значения.
Научное объяснение явлению изомерии было дано А. М. Бутлеровым в рамках теории строения, в то время, как ни теория типов, ни теория радикалов не раскрывали сути этого явления. Бутлеров усматривал причину изомерии в том, что атомы в молекулах изомеров связаны в различном порядке. Теория строения позволяла предсказать число возможных изомеров и их структуру, что было блестяще подтверждено на практике самим Бутлеровым и его последователями.
Поскольку некоторые сведения об изомерии учащимся уже известны, учитель просит привести простейшие примеры, иллюстрирующие это явление, и предложить признак, по которому можно было бы ее классифицировать. Очевидно, что это — строение молекул изомеров.
Именно этот признак, положенный в типологию изомерии, отражен с помощью следующей схемы (рис. 2).
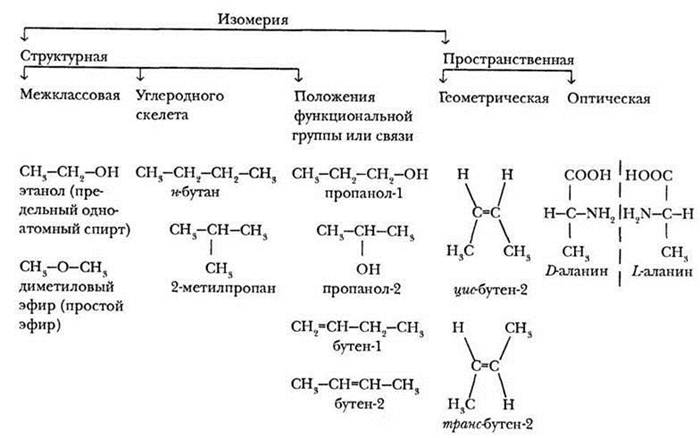
Рис. 2. Типы изомерии
Учитель объясняет материал, обращаясь к этой схеме.
Различают два типа изомерии: структурную и пространственную (или стереоизомерию). Структурными называются изомеры, имеющие различный порядок связи атомов в молекуле. Пространственные изомеры имеют одинаковые заместители у каждого атома углерода, но отличаются их взаимным расположением в пространстве.
Структурная изомерия бывает трех видов: межклассовая, изомерия, связанная со строением углеродного скелета, и изомерия положения функциональной группы или кратной связи.
Межклассовые изомеры содержат различные функциональные группы и принадлежат к разным классам органических соединений. Учитель обращает внимание на то, что физические и химические свойства межклассовых изомеров значительно отличаются.
Изомерия углеродного скелета наиболее знакома учащимся. Они уже без особого труда соберут из модели молекул изомеров бутана или пентана. Их физические свойства различны, а химические — похожи, т. к. эти вещества относятся к одному классу.
Изомерия положения функциональной группы или положения кратных связей также не вызывает сложностей. Физические свойства таких изомеров различны, а химические - похожи.
Пространственная изомерия — новый и достаточно сложный для понимания материал. Если есть возможность, учитель объясняет геометрическую изомерию с использованием шаростержневых моделей молекул, если нет - делает рисунки на доске.
Учитель просит ребят вспомнить структурную формулу этилена и изображает ее на доске:
Можно упомянуть, что молекула этилена плоская и поворот атомов относительно двойной связи невозможен. Учитель предлагает ребятам построить на основе этилена молекулу следующего гомолога - пропилена. Учащиеся приходят к выводу, что, поскольку все атомы водорода в этилене равноценны, это можно сделать единственным образом:
и убеждаются, что изомеров у пропена нет.
Появление метильной группы дает возможным написание уже четырех изомерных бутенов.
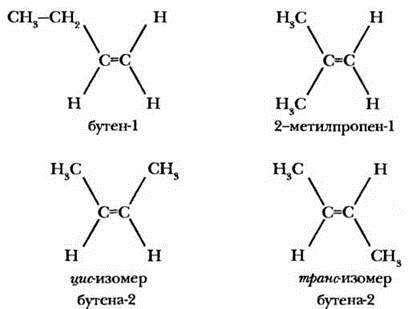
Первая пара изомеров - пример изомерии углеродного скелета. А вот вторая пара имеет совершенно одинаковый порядок связи атомов в молекулах, но концевые метильные группы имеют различное расположение в пространстве. Положение по одну сторону от линии двойной связи называется цис-положение (цис-изомер), а по разные стороны - транс-положение (транс-изомер). Геометрические изомеры имеют различные физические константы, но похожие химические свойства.
Оптические изомеры могут иметь только вещества, имеющие асимметрический атом углерода. Учитель просит записать определение:
Асимметрическим центром называется атом углерода, связанный с четырьмя различными заместителями.
В качестве примера молекул с асимметрическим центром приводится α-аланин или молочная кислота. Ребята находят асимметрический центр и помечают его звездочкой.

Оптические изомеры являются зеркальным изображением друг друга подобно двум ладоням, их невозможно совместить так, чтобы они совпали.
Ребята устали, самое время отдохнуть. Учитель демонстрирует пару перчаток как модель оптических изомеров. Затем просит учащихся скатать из пластилина два набора по пять шариков одинакового размера и разного цвета, а затем показывает, как надо соединить первый набор спичками, чтобы получить тетраэдрическую модель. Для получения зеркальной модели из второго набора нужно сделать точно такую же «молекулу», но поменять местами два любых шарика. Учащиеся убеждаются, что получились разные молекулы, они отличаются друг от друга.
Заканчивая объяснение нового материала, учитель рассказывает о значении оптической изомерии в природе. Несмотря на то что физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху.
Если останется время, можно провести занимательный эксперимент.
Вкус и запах мятной жвачки обусловлен присутствием вещества, называемого L -карвон. По изображенной на доске формуле ребята отыскивают асимметрический атом углерода и помогают учителю написать формулу оптического изомера. Он называется D -карвон и обладает запахом тмина.
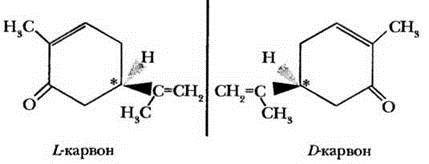
Большинство людей различают запах мяты и тмина. Можно это проверить. Учитель кладет в одну пробирку таблетку мятной жвачки, во вторую - 10 семян тмина, в третью - либо тмин, либо жвачку. Затем помощник оборачивает пробирки бумагой, пишет номера 1, 2, 3 и просит нескольких ребят понюхать содержимое каждой пробирки по очереди и сказать, какие пробирки пахнут одинаково, а в какой запах отличается. Пока старшеклассники с удовольствием тренируют обоняние, можно вскользь упомянуть, что мятная жвачка даже рядом с мятой не лежала. Этот аромат ей придает карвон или ментол, получаемый синтетически.
Главным итогом урока должно стать умение ребят решать задачи следующего типа: распознавать изомеры по структурным формулам веществ; определять тип изомерии; выяснять вопрос о наличии в молекуле асимметрического центра и существовании оптических изомеров. Примеры таких задач приведены ниже.
Какие из веществ, структурные формулы которых приведены ниже, являются изомерами?
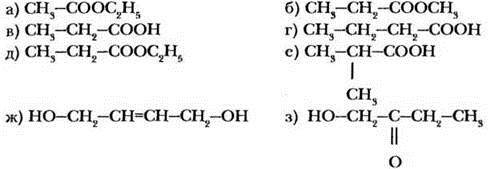
Приведены структурные формулы шести изомеров. Укажите для каждой пары тип изомерии.
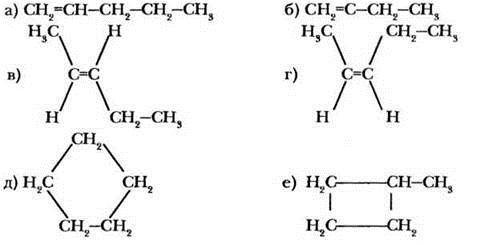
Какие из приведенных формул соответствуют изомерам, а какие - одному и тому же веществу?
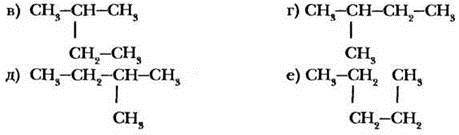
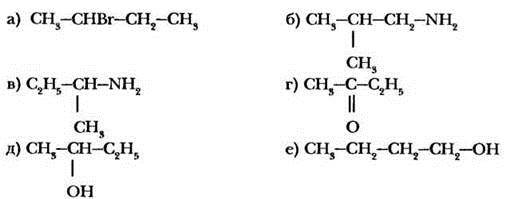
Имеют ли оптические изомеры следующие соединения?
Больше информации по теме: http://compendium.su
